Singapur revidiert System zur Änderungsmeldung für Medizinprodukte
有任何问题?向我们的专家获取相关信息
联系我们2015年 12月 3日
Die Health Sciences Authority (HSA) in Singapur hat am 1. Dezember 2015 Änderungen am Meldesystem für Änderungen an Medizinprodukten eingeführt.

Die neue Richtlinie der HSA enthält mehrere Änderungen (Link auf Englisch), die das Meldeverfahren für registrierte Produkte laut Behörde effizienter gestalten sollen. Die Meldepflicht bedeutet, dass Hersteller die HSA über Änderungen oder Modifikationen an ihren Produkten zeitgerecht informieren müssen, um ihre Produkte weiterhin legal in Singapur zu vertreiben.
Die wesentlichen Änderungen am Meldeverfahren umfassen:
- Beim Hinzufügen eines Produkts mit einem anderen Markennamen zu einer registrierten Eintragung kann keine Änderungsmeldung übermittelt werden. Es muss ein neuer Zulassungsantrag bei der HSA gestellt werden.
- Das Hinzufügen von neuen Modellen zu einem eingetragenen Produkt fällt ab nun unter die Prüfungsänderungskategorie des Änderungsmanagementverfahrens der HSA.
- In Fällen, in denen Änderungsmeldungen aufgrund von Vorkommnissen oder Korrekturmaßnamen notwendig wurden, sollten die Antragsteller Dokumente wie Sicherheitshinweise, Bewertungen des Gesundheitsrisikos, Analysen der Ursachen und Dokumente zu Korrektur- und präventiven Maßnahmen übermitteln.
- Nach der Genehmigung der Änderung durch die HSA darf ein Hersteller nur dann sowohl das ursprünglich registrierte Produkt sowie das geänderte Produkt in Singapur vertreiben, wenn beide Versionen des Produkts den grundlegenden Sicherheits- und Leistungsanforderungen entsprechen.
Die neue Richtlinie enthält außerdem eine Tabelle, in der die einzelnen Klassen von Medizinprodukten und die entsprechenden vier Arten von Änderungsmeldungen zugeordnet werden (Technische Änderungen, Prüfungsänderungen, administrative Änderungen und/oder Meldungen):
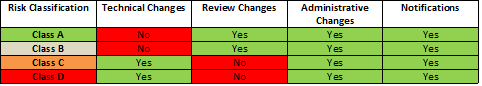
Die betroffenen Antragsteller sollten sich mit der neuen Richtlinie vertraut machen und ermitteln, ob und wie diese Änderungen am HSA-Änderungsmeldesystem ihren Betrieb beeinflussen.
Zusätzliche Informationen zum Zulassungsverfahren für Medizinprodukte in Singapur finden Sie in unserem Whitepaper (auf Englisch) und in unserem Übersichtsvideo (ebenfalls auf Englisch).