FDA-Bericht: bessere Beantwortung von Anfragen nach Zusatzinformationen bei 510(k)-Anträgen
有任何问题?向我们的专家获取相关信息
联系我们2015年 11月 20日
Daten in einem neuen Bericht der US Food and Drug Administration zeigen, dass die Anzahl der Anfragen nach zusätzlichen Informationen (Additional Information, AI) bei 510(k)-Anträgen weiterhin hoch bleibt, dass sie jedoch seit 2010 leicht gesunken ist.
Der Prozentanteil der 510(k)-Anträge, bei denen im Rahmen der ersten Prüfung zusätzliche Informationen angefordert wurden, betrug im Jahr 2014 70 % und beträgt in diesem Jahr 69 %, so der Bericht (auf Englisch) zum Stand in Bezug auf die Medizinprodukte-Erfolgsziele der FDA bis 30. September 2015. Die Anzahl der Anfragen nach Zusatzinformationen bei der ersten Prüfung von 510(k)-Anträgen stieg zwischen 2002 (36 % der Anträge) und 2011 (77 %) stark an.
Bis 2012 stieg der Prozentsatz der 510(k)-Anträge, bei denen im Rahmen der zweiten Prüfungsrunde Zusatzinformationen angefordert wurden, ebenfalls stark an, fiel jedoch danach ab, wie in der Grafik unten zu sehen ist.
Anfragen nach Zusatzinformationen bei 510(k)-Anträgen in der ersten bzw. zweiten Prüfungsrunde
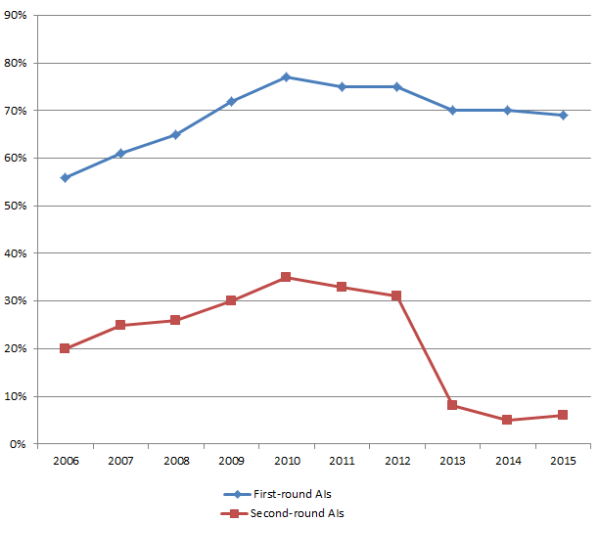
Quelle: US FDA
Hinter den Zahlen
Obwohl der MDUFA-Bericht keine Analyse enthält, um diese Prozentsätze zu erklären, decken sich die Zahlen mit dem graduell strengeren Prüfungsansatz der FDA bei 510(k)-Anträgen.
In dem Zeitraum, in dem die Anzahl der 510(k)-AI-Anforderungen in der ersten Prüfungsrunde ihren Höchststand erreichte, beklagten sich Vertreter der Medizinprodukte-Branche auch über die beschwerlichen Zulassungsverfahren der FDA und die neue FDA-Direktorin Margaret Hamburg hatte begonnen, strengere Prüfungsverfahren einzuführen.
Die Tatsache, dass sich die Anzahl der AI-Anfragen in den letzten Jahren eingependelt hat — und in der zweiten Prüfungsrunde dramatisch gefallen ist — weist darauf hin, dass die Antragsteller die Anforderungen der FDA-Prüfer besser kennen, und auch darauf hin, dass die Antragsteller die Anfragen der Prüfer in der ersten Runde besser beantworten, sodass in der zweiten Runde weniger Anfragen nach Zusatzinformationen gestellt werden. Eine genauere Formulierung der Anfragen durch die FDA-Prüfer sowie ausführlichere Antworten der Hersteller könnten diesen Trend erklären. Obwohl auch im September 2015 bei ca. 70 % der 510(k)-Anträge Anfragen nach Zusatzinformationen gestellt werden, erfüllen mehr als 90 % dieser Anträge die FDA-Anforderungen in der zweiten Prüfungsrunde.
Gründe für die vielen Anfragen nach Zusatzinformationen in der ersten Prüfungsrunde
In einem von Emergo analysierten (auf Englisch) FDA-Bericht zu 510(k)-Prüfungszeitrahmen aus dem Jahr 2011 identifizierte die Behörde falsche Produktbeschreibungen als den häufigsten Grund für Anfragen nach Zusatzinformationen in der ersten Prüfungsrunde. Andere Gründe für solche Anfragen umfassen unvollständige oder fragwürdige Hinweise zur Verwendung und die Nichteinhaltung aktueller Richtlinien.
Obwohl 510(k)-Antragsteller weiterhin diesbezügliche Probleme bei der Antragstellung haben, kann ein größerer Teil der Hersteller diese nach Erhalt einer AI-Anfrage beseitigen.
作者
- Stewart Eisenhart