Rapport FDA : augmentation des inspections des BPF (QSR) à l'étranger en 2014
有任何问题?向我们的专家获取相关信息
联系我们2015年 11月 17日
En 2014, la FDA des États-Unis a augmenté le nombre de ses inspections qualité sur les sites de fabrication de DM situés à l'étranger, continuant ainsi sa démarche entreprise sur le long terme pour contrôler la conformité aux BPF FDA des sites établis hors des États-Unis.
Selon le rapport, Selon le rapport, la FDA a effectué plus d'inspections du système de gestion de la qualité 21 CFR Part 820 en 2014 que les années précédentes, et a également augmenté le nombre de ses inspections des inscrits sur le marché des États-Unis établis dans d'autres pays. Un pourcentage plus élevé d'observations et de lettres d'avertissement a été émit pour des fabricants étrangers qu'en direction des entreprises établies aux États-Unis.
Davantage d'inspections pour les entreprises étrangères
Le rapport indique que la FDA a procédé à plus d'inspections de fabricants et de sites de fabrication à l'étranger ces dernières années car le nombre de ces entreprises a augmenté. En 2014, l'agence américaine a mené des inspections du système qualité dans 594 sites étrangers, comparé à 460 en 2013. Pour la même période, les inspections de fabricants américains ont diminuées, de 1741 en 2013 à 1619 en 2014. Cette tendance montre que la FDA consacre de manière constante plus de ses ressources à des inspections étrangères au léger (mais pas insignifiant) détriment de celles sur son territoire.
Depuis 2011, l'agence a régulièrement augmenté ses inspections QSR (BPF) des sites étrangers, tout en réduisant légèrement le nombre de celles effectuées aux États-Unis. En 2011, environ 85 % des inspections QSR s'effectuaient au niveau national contre 15 % à l'étranger ; en 2014 le pourcentage de ces inspections aux États-Unis est tombé à 73 %, contre 27 % sur des sites à l'étranger.
Inspections QSR FDA nationales / à l'étranger de 2011 à 2014
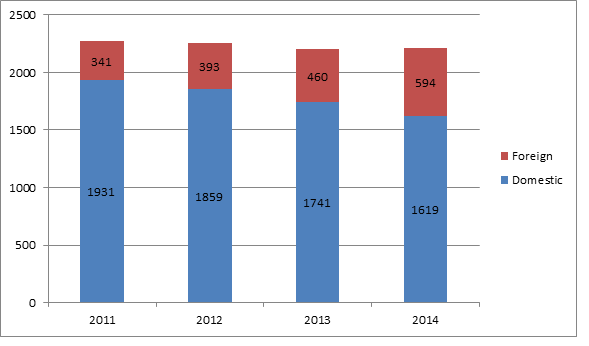
Source: US FDA
La plupart des inspections du système qualité à l'étranger se sont déroulées en Chine (190), en Allemagne (72), au Japon (37) et à Taïwan (29). Dans les 10 premiers emplacements des inspections, une grande majorité des sites (279) se situaient en Asie, reflétant l'optique orientée vers l'exportation de cette région.
Un pourcentage plus élevé d'observations pour les inscrits étrangers
La FDA ayant augmenté le nombre de ses inspections à l'étranger en 2014, il n'est peut-être pas surprenant que les inspecteurs aient signalé un pourcentage plus élevé d'observations, en particulier concernant des mesures officielles, parmi les sites étrangers, avec peu ou pas d'expérience, qui se voient inspectés.
|
Inspections aux États-Unis |
Inspections à l'étranger |
||
|
Décision |
Pourcentage |
Décision |
Pourcentage |
|
Aucune mesure préconisée |
52% |
Aucune mesure préconisée |
42% |
|
Mesure(s) volontaire(s) préconisée(s) |
40% |
Mesure(s) volontaire(s) préconisée(s) |
43% |
|
Mesure(s) officielle(s) préconisée(s) |
8% |
Mesure(s) officielle(s) préconisée(s) |
15% |
Source: US FDA
Dans l'ensemble, les inspections du système de qualité qui n'ont débouché sur aucune demande de mesures à prendre ont légèrement augmenté, de 52 % en 2013 à 54 % en 2014 ; le rapport montre que, depuis 2008, le pourcentage de ce type d'inspections est demeuré stable, juste au-dessus de 50 %. Les mesures volontaires préconisées ont également légèrement diminué à 38 % des inspections en 2014, pour 41 % en 2012 et 2013. Le pourcentage avec mesures officielles préconisées est cependant passé de 8 % en 2013 à 9 % en 2014. Là encore, la légère hausse constante des pourcentages des mesures officielles peut vraisemblablement être attribuée à l'augmentation des inspections des sites étrangers qui ne connaissent pas les exigences de conformité des BPF (QSR).
Types d'observations : Prod. & Maîtr. Proc. encore les plus fréquentes
Selon le rapport, la totalité des observations résultants des inspections des sites de fabrication étrangers et aux États-Unis s'élève à 3740, dont la majeure partie concernaient la production et les maîtrises des processus (P & MP; 32 % de toutes les observations) et les mesures correctives et préventives (MCMP; 31 %).
Ces résultats illustrent encore que, quel que soit le lieu de production des dispositifs enregistrés auprès de la FDA, les problèmes de P & MP et de MC & MP justifient une attention minutieuse et suivie pour pouvoir répondre aux exigences de conformité aux BPF.
En termes d' observations Form 483, 57 % des sites étrangers inspectés en ont reçu, et 47 % des sites établis aux États-Unis. Étant donné que, pour bon nombre de ces sites à l'étranger, il s'agissait probablement de leur première inspection des BPF, ces résultats paraissent logiques, les fabricants nationaux connaissant mieux l'approche des inspecteurs.
Cependant, c'est un nombre beaucoup plus élevé de sites établis aux États-Unis qui ont reçu des lettres d'avertissement pointant le système qualité, par rapport aux sites de fabrication étrangers. Bien que le nombre total des lettres d'avertissement émises en 2014 tombe à 121, de 144 en 2013 et 2012, le nombre des sites recevant ces lettres aux États-Unis est passé de 70 pour l'année précédente, à 76. En revanche, seulement 45 sites étrangers ont reçu des lettres d'avertissement en 2014, comparé à 74 en 2013.
Comme ce fut le cas avec les observations « Form 183 » et relatives au système de qualité, la plupart des lettres d'avertissement émises en 2014 concernaient les MC & MP (90 % des lettres) et sous-systèmes P & MP (85 %).
Vous trouverez d'autres informations à ce sujet dans le livre blanc d'Emergo sur le déroulement des inspections des BPF de la FDA.
作者
- Stewart Eisenhart