FDA-Bericht: mehr QSR-Inspektionen an ausländischen Standorten im Jahr 2014
有任何问题?向我们的专家获取相关信息
联系我们2015年 11月 10日
Die US Food and Drug Administration erhöhte im Jahr 2014 die Anzahl der Qualitätssicherungssysteminspektionen an Fertigungsstätten für Medizinprodukte im Ausland. Die Inspektionen sind Teil der jahrelangen Bemühungen der FDA, die Überwachung der Einhaltung der Guten Herstellungspraxis der FDA an ausländischen Standorten zu verbessern.
Laut Bericht (auf Englisch) führte die FDA im Jahr 2014 mehr Qualitätsmanagementsysteminspektionen nach 21 CFR Part 820 durch als in den Jahren davor und erhöhte auch die Anzahl der Inspektionen an ausländischen Standorten. Hierbei wurden mehr Warnschreiben an ausländische Hersteller als an in den USA ansässige Firmen ausgestellt.
Vermehrte Inspektion von ausländischen Unternehmen
Die FDA hat sich in den letzten Jahren auf die Inspektion von ausländischen Medizinprodukte-Herstellern konzentriert, da sich die Bestände dieser Firmen erhöht haben, so der Bericht. Im Jahr 2014 führte die Behörde an 594 ausländischen Standorten Inspektionen des Qualitätssicherungssystems durch, im Vergleich zu 460 Inspektionen im Jahr 2013. Im gleichen Zeitraum nahm die Anzahl der Inspektionen von Herstellern in den USA ab, von 1741 im Jahr 2013 auf 1619 im Jahr 2014. Dieser Trend zeigt, dass die FDA fortlaufend mehr Ressourcen für Inspektionen im Ausland auf Kosten der inländischen Inspektionen aufwendet.
Seit 2011 hat die Behörde die QSR-Inspektionen im Ausland stetig erhöht, wobei gleichzeitig die Anzahl der in den USA durchgeführten Inspektionen leicht gesunken ist. Im Jahr 2011 wurden 85 % aller QSR-Inspektionen der FDA in den USA und 15 % im Ausland durchgeführt. Im Vergleich dazu fiel der Prozentsatz der QSR-Inspektionen im Jahr in den USA auf 73 %, wobei 27 % der Inspektionen im Ausland erfolgten.
Anzahl der QSR-Inspektionen durch die FDA in den USA und im Ausland von 2011 bis 2014
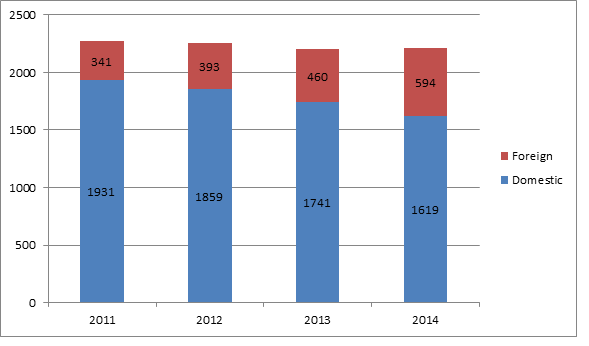
Quelle: US FDA
Die meisten Qualitätssicherungssysteminspektionen wurden in China (190) durchgeführt, gefolgt von Deutschland (72), Japan (37) und Taiwan (29). Die meisten der ausländischen Standorte (279) befanden sich in Asien, was die starke Exportorientierung des Raumes widerspiegelt.
Größerer Prozentsatz von Problemen im Ausland
Aufgrund der vermehrten Inspektion von ausländischen Herstellern im Jahr 2014 ist es vermutlich keine Überraschung, dass die FDA-Prüfer mehr Probleme an ausländischen Standorten beobachteten, insbesondere an solchen, die keine Erfahrung mit solchen Inspektionen hatten.
|
Inspektionen in den USA |
Inspektionen im Ausland |
||
|
Entscheidung |
Prozentsatz |
Entscheidung |
Prozentsatz |
|
Keine Beanstandung |
52 % |
Keine Beanstandung |
42 % |
|
Empfehlung freiwilliger Maßnahmen |
40 % |
Empfehlung freiwilliger Maßnahmen |
43 % |
|
Anweisung offizieller Maßnahmen |
8 % |
Anweisung offizieller Maßnahmen |
15 % |
Quelle: US FDA
Insgesamt sind sich die QMS-Inspektionsergebnisse ohne Beanstandung leicht von 52 % im Jahr 2013 auf 54 % im Jahr 2014 gesunken. Seit 2008 sind die Inspektionen ohne Beanstandung bei knapp über 50 % ungefähr gleich geblieben. Die Inspektionen, nach denen freiwillige Maßnahmen empfohlen wurden, sind ebenfalls leicht von 41 % in den Jahren 2012 und 2013 auf 38 % der Inspektionen im Jahr 2014 gesunken. Die Fälle, bei denen die Durchführung offizieller Maßnahmen angewiesen wurde, sind auf von acht Prozent im Jahr 2013 auf neun Prozent im Jahr 2014 gestiegen. Dieses leichte Ansteigen kann vermutlich durch die vermehrte Inspektion ausländischer Standorte erklärt werden, die nicht mit den QSR-Vorschriften vertraut sind.
Arten der aufgedeckten Mängel: P&PC, CAPA am häufigsten
Laut dem Bericht der FDA wurden insgesamt 3.740 Mängel bei Inspektionen in den USA und im Ausland entdeckt. Die meisten dieser Mängel betrafen die Produktions- und Prozesssteuerung (P&PC, 32 % aller Mängel) und Korrekturmaßnahmen und präventive Maßnahmen (CAPA, 31 %).
Diese Ergebnisse illustrieren, dass Hersteller, deren Produkte von der FDA zugelassen sind, unabhängig vom Standort ihrer Fertigungsstätten P&PC und CAPA beachten sollten, um die QSR-Vorschriften einzuhalten.
Bei 57 % der ausländischen inspizierten Standorte gab es Beanstandungen, bei denen das Formular 483 ausgestellt wurde, im Vergleich zu 47 % der Standorte in den USA. Die wahrscheinliche Erklärung dafür ist, dass viele dieser ausländischen Standorte zum ersten Mal einer QSR-Inspektion unterzogen wurden und daher keine Erfahrung mit diesen Inspektionen hatten.
Eine wesentlich höhere Anzahl von US-Standorten als ausländische Hersteller erhielten jedoch Warnschreiben in Bezug auf ihre Qualitätssicherungssysteme. Obwohl die Gesamtanzahl der im Jahr 2014 ausgestellten Warnschreiben auf 121 fiel, von jeweils 144 in den Jahren 2012 und 2013, stieg die Anzahl der Standorte in den USA, die diese Warnschreiben erhielten, von 70 im Jahr 2013 auf 76 im Jahr 2014. Im Vergleich dazu erhielten nur 45 ausländische Standorte im Jahr 2014 Warnschreiben, verglichen mit 74 im Jahr davor.
Genau wie bei den Formularen 483 bezogen sich die meisten der im Jahr 2014 ausgestellten Warnschreiben auf CAPA (90 % der Schreiben) und P&PC (85 %).
Weitere Informationen zu QSR-Inspektionen durch die FDA finden Sie in Emergos Whitepaper (auf Englisch).
作者
- Stewart Eisenhart