FDA-Daten zeigen seit 2005 Anstieg bei Warnschreiben an Medizinprodukte-Unternehmen
有任何问题?向我们的专家获取相关信息
联系我们2013年 5月 11日
Wie die Inspektionsdaten der FDA zeigen, steigt die Anzahl der Warnschreiben, die die Qualitätssystem-Inspektoren der US Food and Drug Administration für Medizinprodukte ausstellen, seit 2005 ständig.
Die wachsende Anzahl der Ausstellungen von Formularen 483 und von Warnschreiben steht in Einklang mit der seit 2008 steigenden Anzahl der Inspektionen auf Einhaltung der FDA Qualitätssystemvorschriften. Im Jahr 2008 wurden von FDA-Mitarbeitern 1423 Qualitätssysteminspektionen bei Medizinprodukte-Unternehmen durchgeführt, im Jahr 2011 2121 Inspektionen und im Jahr 2012 2087 Inspektionen. Es ist klar, dass die US-Behörden bei einer wachsenden Anzahl an Inspektionen auch mehr Probleme bei der Nichteinhaltung der Vorschriften aufdecken.
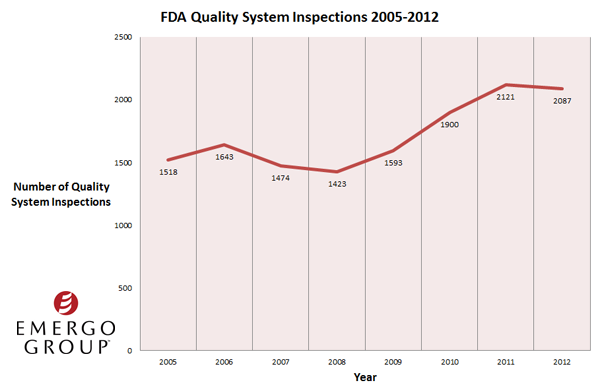
FDA Medizinprodukte-QSR-Qualitätssysteminspektionen
Es stellt sich jedoch die Frage, welche Arten an Problemen am häufigsten von den Inspektoren bemängelt werden, und auf welche Komponenten ihrer Qualitätssysteme Medizinprodukte-Hersteller daher besonders achten sollten, um Formular 483 Warnschreiben oder Strafen zu vermeiden. Nach den Daten von 2012 zu schließen, sollten Corrective and Preventative Action (CAPA, Korrekturen und vorbeugende Maßnahmen) sowie Production and Process Controls (P&PC, Produktions- und Prozesslenkung) besonders beachtet werden. Probleme bei diesen Mechanismen waren im letzten Jahr für 30 % der 483-Probleme verantwortlich, eine wesentlich größere Anzahl als bei Management, Design und Dokumentenmanagement.

FDA-Warnschreiben bei Qualitätssystemen 2005-2012
Die Anzahl der abgestraften Qualitätssystemprobleme ist ebenfalls dramatisch gestiegen, seit die FDA ihren aggressiveren Inspektionsplan umgesetzt hat. Seit 2009 ist die Anzahl der Warnschreiben stetig gestiegen, wobei der größte Zuwachs zwischen 2011 und 2012 stattgefunden hat. Ist dieser Anstieg bei aufgedeckten Problemen auf einen Rückgang der Einhaltung von Qualitätssystemvorschriften durch Medizinprodukte-Hersteller zurückzuführen? Vermutlich nicht. Es ist wahrscheinlicher, dass durch die größere Inspektionsfrequenz Probleme aufgedeckt wurden, die bei den weniger häufigen und weniger gründlichen Inspektionen vor dem Jahr 2009 übersehen wurden.
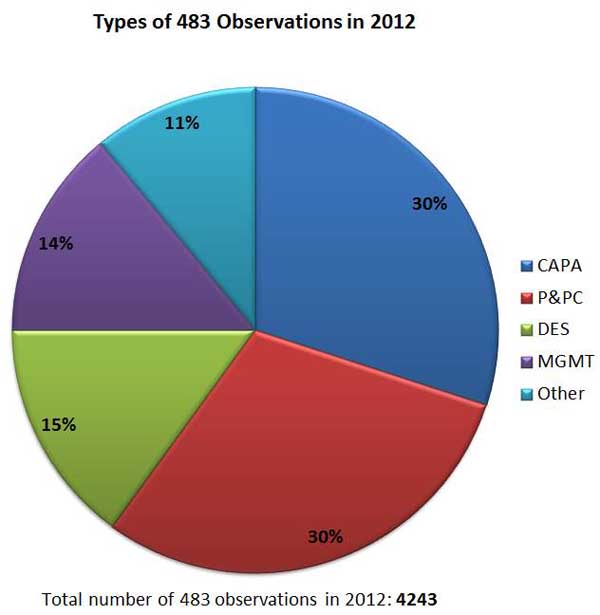
Arten der 483 QSR-Qualitätssystemprobleme
Zusammenfassung: Die Daten zu den FDA 483-Warnschreiben unterstützen die Behauptungen der Medizinproduktebranche, dass die Anzahl der Qualitätssysteminspektionen in den letzten vier Jahren gestiegen ist. Medizinprodukte-Unternehmen sollten erwarten, dass dieser Trend bei FDA-Inspektionen auch in Obamas zweiter Amtsperiode beibehalten wird. Die Daten zeigen außerdem genau, welche QSR-Qualitätssystemkomponenten am häufigsten von den Inspektoren kritisiert werden. Medizinprodukte-Hersteller auf dem US-Markt sollten ihre CAPA- und P&PC-Verfahren besonders beachten, um die Einhaltung von 21 CFR Teil 820 sicherzustellen.
作者
- Stewart Eisenhart