Bericht der US FDA: bessere RTA-Quoten, kürzere Zulassungsverfahren für Medizinprodukte
有任何问题?向我们的专家获取相关信息
联系我们2015年 8月 21日
In einem neuen Bericht, der von der US Food and Drug Administration veröffentlicht wurde, werden eine wesentliche Reduktion der Annahmeverweigerung (Refuse to Accept, RTA) von unvollständigen Zulassungsanträgen sowie allgemein kürzere Zeitrahmen für Zulassungsverfahren für Medizinprodukte zwischen 2010 und 2014 aufgezeigt.
Die Behörde berichtet (Link auf Englisch) von kürzeren Prüfungszeitrahmen für 510(k)-, PMA- und IDE-Anträge sowie für De-novo-Prüfverfahren für innovative Produkte und Technologien. Als Gründe dafür werden verschiedene interne Richtlinien- und Programmänderungen seit 2010 sowie externe Faktoren angegeben, die mit dem Medical Device User Fee and Modernization Act (Medizinprodukte-Gebühren- und Modernisierungs-Gesetz, MDUFMA) und dem FDA Safety and Information Act (FDA Sicherheits- und Informations-Gesetz, FDASIA) zusammenhängen.
Weniger RTA-Ablehnungen im Jahr 2015
Ein weiteres wichtiges Ergebnis des FDA-Berichts bezieht sich auf die RTA-Richtlinie (Refuse to Accept, Annahmeverweigerung) der Behörde, in derem Rahmen 510(k)-Anträge zuerst auf Vollständigkeit geprüft und bei Mängeln abgelehnt werden.
Die FDA berichtet über eine 20-prozentige Reduktion solcher Fälle: Die RTA-Quoten fielen von 57 % im ersten Quartal 2014 auf 37 % im zweiten Quartal 2015. Die FDA führt diese Abnahme auf bessere Schulungen sowie größere RTA-Transparenz zurück, was wiederum zu weniger Fehlern und Auslassungen bei 510(k)-Anträgen geführt haben könnte. Seit Einführung der RTA Anfang 2013 hat die Anzahl der abgelehnten Anträge stetig abgenommen, was auf eine bessere Kenntnis der 510(k)-Antragsteller der Komponenten hinweist, die in einem Antrag an die FDA enthalten sein müssen.
Wesentliche Reduktion der Prüfzeiten für IDEs, De-novo-Anträge
Die dramatischste Zeitreduktion wurden bei IDE- und De-novo-Prüfungen gefunden. Die IDE-Prüfzeiten wurden laut FDA um mehr als ein Jahr verkürzt, und De-novo-Prüfzeiten verkürzten sich von mehr als drei Jahren im Jahr 2010 auf 10 Monate im Jahr 2014. Wie Abbildung 1 zeigt, fielen die Prüfzeiten für 510(k)- und PMA-Anträge ebenfalls um 13 % bzw. 31 %.
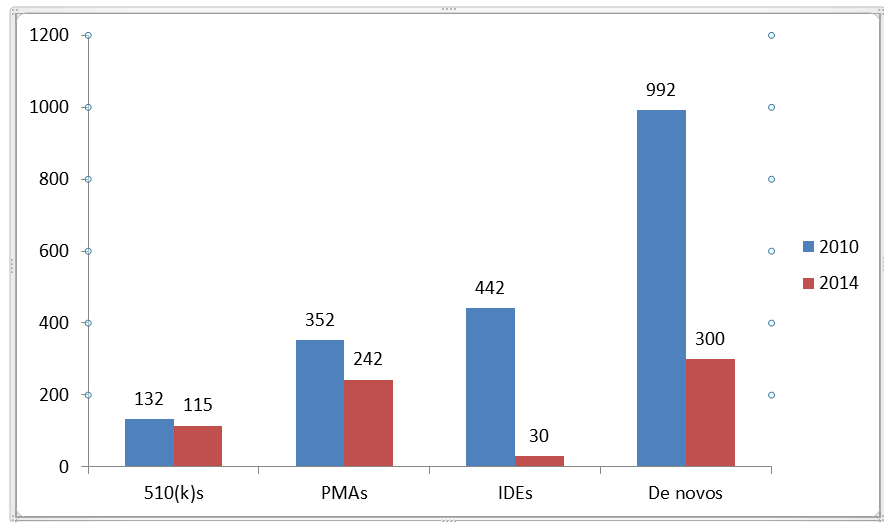
Abbildung 1: Prüfzeiten in Tagen für Ende der Fiskaljahre 2010 und 2014 (Quelle: US FDA)
Die wesentlich kürzeren De-novo-Prüfzeiten können dadurch erklärt werden, dass die FDA Herstellern erlaubt, De-novo-Anträge direkt zu stellen, ohne vorher ein 510(k)-Verfahren zu durchlaufen und ohne die Entscheidung zu erhalten, dass es kein wesentliches Vergleichsprodukt (Not Substantially Equivalent, NSE) gibt.
Kürzere Prüfzeiten bedeuten mehr Zulassungen
Der FDA-Bericht zeigt auch, wie die kürzeren Prüfzeiten zu einer größeren Anzahl an für den Vertrieb in den USA zugelassenen Medizinprodukten geführt haben.
Laut Behörde ist die Anzahl der genehmigten 510(k)-Anträge von 73 % im Jahr 2010 auf 84 % im Jahr 2014 gestiegen ist. Die Anzahl der von der FDA genehmigten PMA-Anträge ist ebenfalls von 59 % im Jahr 2010 auf 86 % im Jahr 2014 gestiegen.
Zusammenfassung
- Die wesentliche Reduktion an RTA-Annahmeverweigerungen sind auf die Öffentlichkeitsarbeit der FDA sowie bessere Kenntnisse der 510(k)-Antragsvorschriften zurückzuführen.
- Ein direkteres De-novo-Antragsverfahren hat die Zulassungszeiten für diese Arten von Medizinprodukten wesentlich verkürzt.
- Programm- und Richtlinienänderungen im Zentrum für medizinische Geräte und Einhaltung der Strahlensicherheit (Center for Devices and Radiological Health, CDRH) der FDA haben zu verkürzten 510(k)- und PMA-Prüfzeiten geführt.
作者
- Stewart Eisenhart