Rapport FDA : les demandeurs de 510 (k) répondent mieux aux demandes d'informations complémentaires
有任何问题?向我们的专家获取相关信息
联系我们2015年 11月 26日
Les données récentes provenant de la Food and Drug Administration des États-Unis montrent que les demandes d'informations complémentaires (AI pour Additional Information) liées aux demandes d'APMM 510 (k) demeurent élevées, mais également que la fréquence de ces demandes AI a légèrement diminué depuis 2010.
Selon un nouveau rapport de la FDA sur les objectifs de performance pour les DM, le pourcentage de demandes 510 (k) entraînant des demandes d'informations complémentaires au cours de leurs premiers examens a atteint 70 % en 2014 et était à 69 % au 30 septembre 2015. Ces demandes découlant des premiers contrôles 510 (k) ont fortement et régulièrement augmenté entre 2002 (36 % des présentations) et 2011 (77 %).
Jusqu'en 2012, le pourcentage de présentations pour 510 (k) qui ont abouties à des demandes d'informations complémentaires (AI) lors de leur second contrôle a suivi une trajectoire similaire, mais a alors chuté de manière significative, comme l'illustre le tableau ci-dessous.
First- Versus Second-Round AI Requests for 510(k) Applications
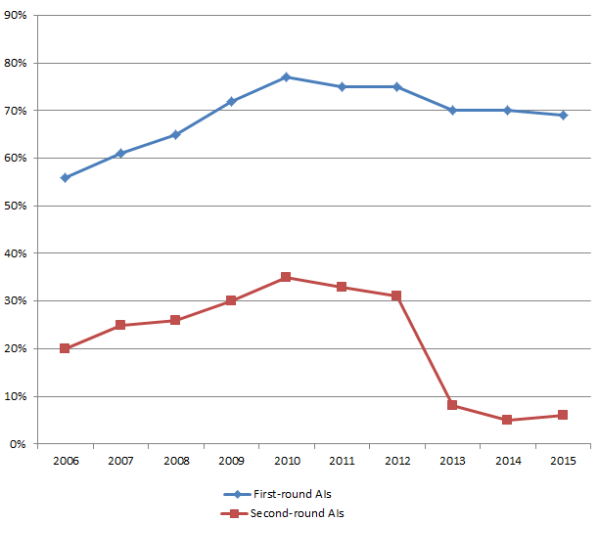
Source: US FDA
Derrière les chiffres
Bien que le rapport MDUFA lui-même n'offre pas d'analyse pour expliquer les raisons de la hausse des demandes d'informations complémentaires, ces chiffres s'alignent sur l'approche progressivement plus rigoureuse des examens des demandes de 510 (k) par la FDA.
Au cours de la période durant laquelle le premier examen des demandes de 510 (k) engendrait plus de demandes d'informations complémentaires, les entreprises du secteur des DM se plaignaient davantage du fait que le parcours d'enregistrement FDA était devenu pénible et lourd, et la nouvelle direction de l'organisme de contrôle, en la personne de Margaret Hamburg, avait commencé à rendre plus exigeant son processus d'examen des dispositifs.
Le fait que les demandes d'informations complémentaires ont commencé à se stabiliser au cours des dernières années — et à considérablement chuter en deuxième phase de contrôle 510 (k)— suggère que certains demandeurs de 510 (k) sont devenus plus attentifs et au courant des exigences des examinateurs FDA, mais montre plus fortement que les demandeurs répondent de manière plus adéquate aux premières demandes d'informations complémentaires pour qu'ensuite la deuxième phase des contrôles n'en génèrent plus. Des demandes plus explicites de la part des examinateurs FDA et des réponses plus complètes de la part des fabricants peuvent expliquer cette tendance. Ainsi, bien qu'à la date de septembre 2015 70 % des demandes de 510 (k) reçoivent encore des demandes d'informations complémentaires au premier examen, plus de 90 % de ces demandes 510 (k) sont en mesure de répondre aux exigences de la FDA lors de la seconde phase des contrôles.
Un effet de la procédure/politique RTA ?
Un autre facteur est à considérer en regard de la baisse des demandes d'informations complémentaires au premier examen, il s'agit de la nouvelle procédure RTA (Refuse to Accept) par laquelle la FDA vérifie que les demandes d'APPM soient bien complètes avant que tout examen approfondi ne débute. Les présentations jugées incomplètes sont renvoyées aux demandeurs, corrigées, puis présentées à nouveau. Introduite fin 2012 et mise en application en 2013, la procédure RTA pourrait-elle avoir un effet sur le pourcentage des demandes d'informations complémentaires ?
Audrey Swearingen, responsable des questions réglementaires pour Emergo, répond : « Je pense que certains problèmes qui étaient auparavant signalés dans les demandes d'informations complémentaires sont désormais pointés à l'entreprise plus tôt, au cours de la procédure RTA. Le résultat pourrait donc en être que la FDA reçoit des dossiers de demandes 510 (k) plus complets. »
Les raisons du grand nombre de demandes d'informations complémentaires en premier contrôle
Dans un rapport FDA de 2011 analysé par Emergo, portant sur les délais d'examen des demandes de 510 (k), l'organisme avait indiqué que les descriptions non adéquates des dispositifs étaient la première cause des demandes d'informations complémentaires au premier examen. Les autres causes de ces demandes comprenaient des indications d'utilisation incomplètes ou confuses et des non-respects de la directive en vigueur à ce moment-là.
Bien que les demandeurs de 510 (k) puissent encore avoir des difficultés à répondre à ces types de problèmes lors de leur première demande d'APPM aux États-Unis, une plus grande partie d'entre eux sont maintenant en mesure de répondre aux premières demandes d'informations complémentaires de la FDA afin que le contrôle de leur dispositif médical puissent se dérouler.
作者
- Stewart Eisenhart